・内部エネルギーとは
・熱力学第一法則とは
今回は熱力学第一法則についての解説なのですが、物理基礎では簡単に触れて終わりなので、あまり詳しく扱いません。
熱力学第一法則を本格的に使うのは、物理基礎ではなく物理の方であるため、物理基礎だけで大丈夫な人は気軽に勉強してください。
もし物理まで勉強するのであれば、しっかりと勉強しておきましょう。
内部エネルギーとは
分子のもつ運動エネルギー+位置エネルギーのこと
内部エネルギーとは、分子のもつ運動エネルギー+位置エネルギーのことであり、記号はU、単位はエネルギーなので[J]です。
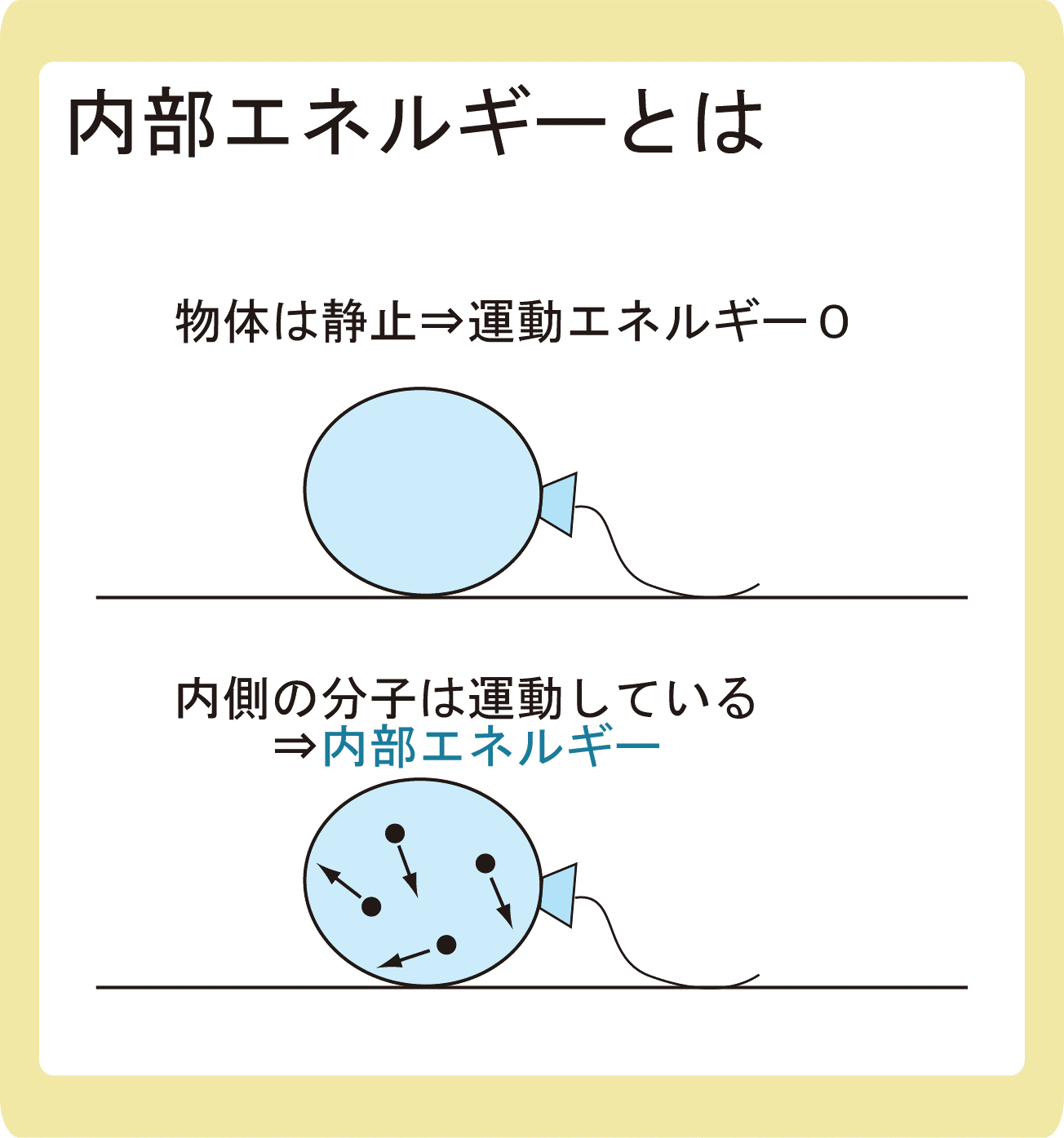
図のように、物体(風船)が静止していたとします。
物体が静止しているので運動エネルギーは0Jなのですが、風船の中には気体が入っており、気体分子は熱運動によって運動しているはずです。
このような、分子の持つエネルギーのことを内部エネルギーと言います。
大雑把なイメージとしては、上の図のようなものだと思ってもらって大丈夫です。
「運動エネルギー+位置エネルギー」とは力学的エネルギーのことだったのではないのか?
と思うかもしれませんが、内部エネルギーは力学的エネルギーとは関係ありません。
物体そのものが運動していたり、物体そのものが位置エネルギーを持っていたりする場合は力学的エネルギー
物体を構成している分子や、気体分子などの細かな熱運動や位置エネルギーを内部エネルギーと言います。
分子と分子の間には分子間力という相互作用がはたらき、分子間力による位置エネルギーというものを持つのですが、高校物理基礎・物理では分子間力による位置エネルギーを無視します。
従って、高校物理でいうところの内部エネルギーは、分子のもつ運動エネルギーということになるので、やはりイメージとしては上の図のようなものだと思って大丈夫です。
この内部エネルギーを使って、熱力学第一法則というものを説明していきます。
熱力学第一法則とは
気体の内部エネルギーは、熱を受け取るか仕事をされると増加する
$$ΔU=Q+W$$
$$Q=ΔU+W’$$
(ΔU:内部エネルギーの変化量[J] Q:気体に与えた熱量[J] W:気体にされた仕事[J] W’:気体がした仕事[J])
熱力学第一法則とは、気体の内部エネルギーは、熱を受け取るか仕事をされると増加することであり、要は、エネルギーは保存するという法則です。
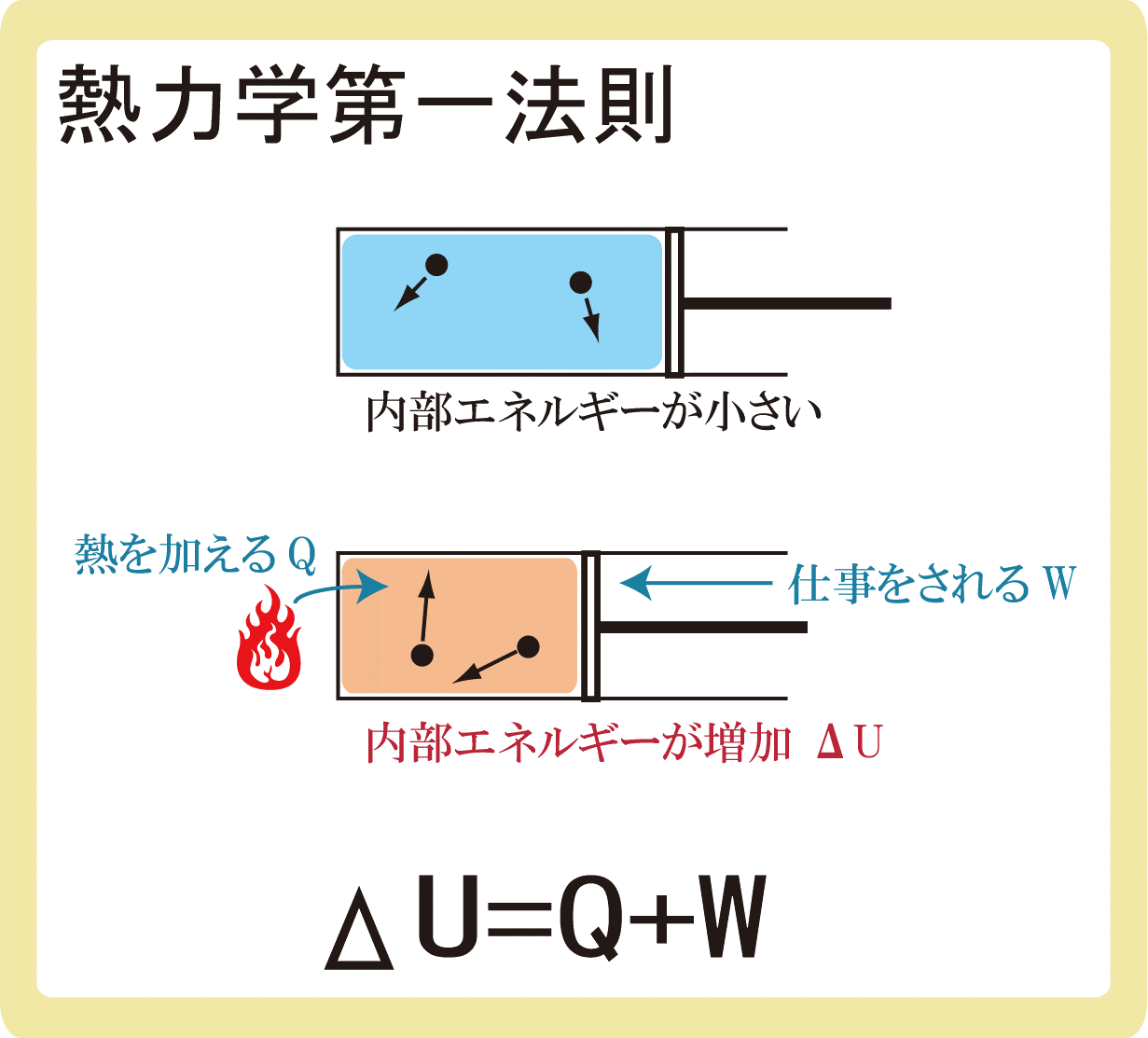
Δは変化を表す記号です。
Uは内部エネルギーであり、ΔUになると内部エネルギーの変化量になります。
この法則は気体だけではなく固体や液体でも成立するのですが、高校物理基礎・物理では気体の話しか出てこないので、ここでは気体という前提で説明をします。
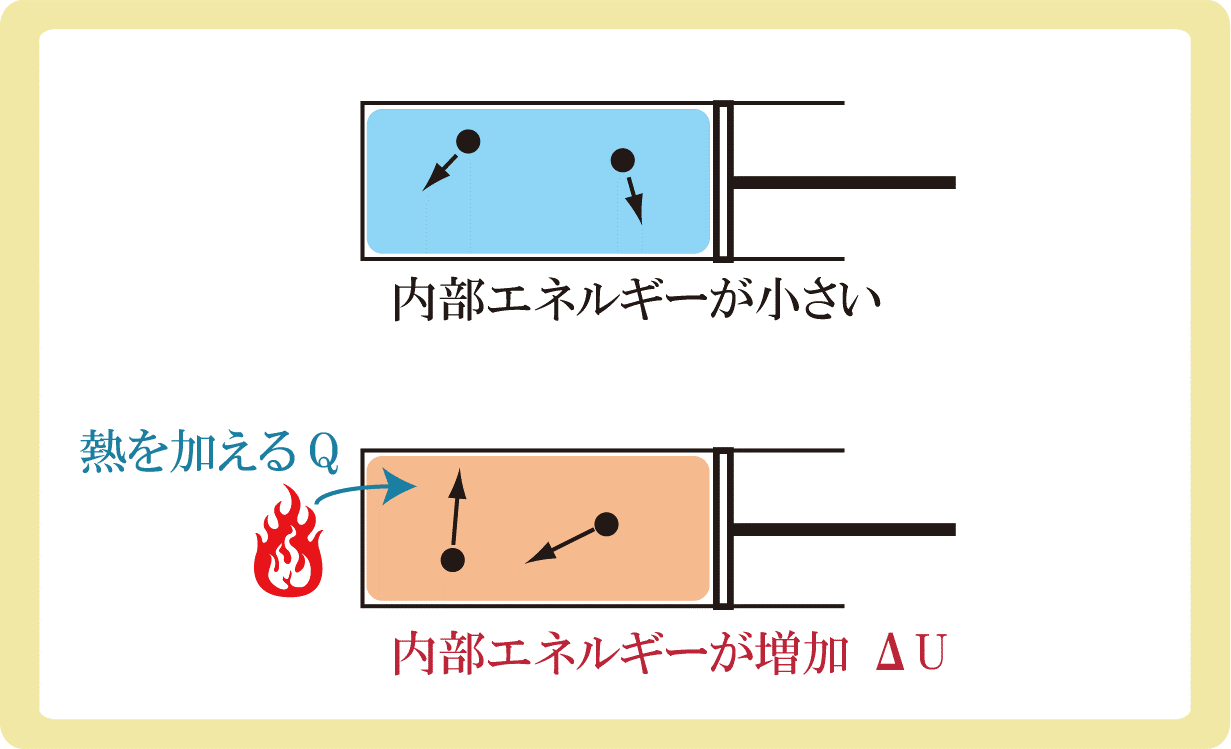
まず、気体に熱を与えると内部エネルギーは増加します。
内部エネルギーが増加するとは、大雑把に言うと気体分子の運動が早くなるということです。
これはとてもイメージしやすいですね。
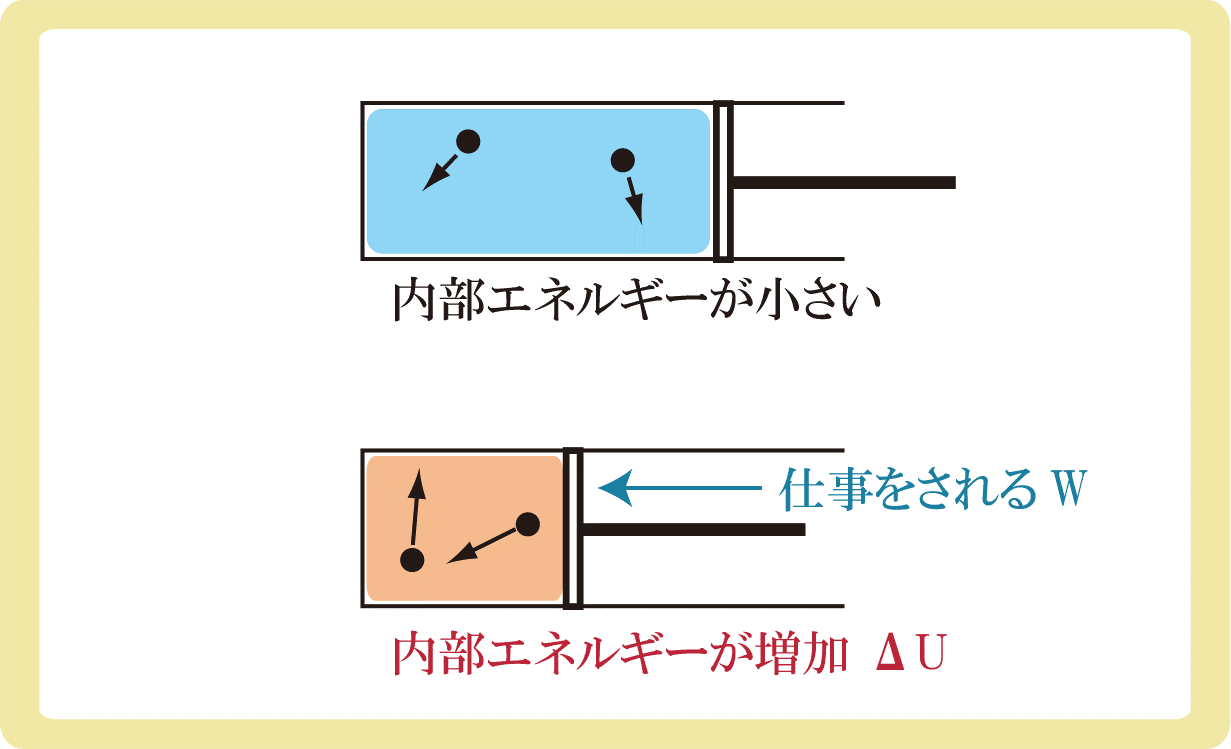
同様に、気体に仕事がされる場合も内部エネルギーが増加します。細かい話は物理基礎ではなく物理の方で説明をします。
熱力学第一法則の公式はどっち?
熱力学第一法則の公式は
$$ΔU=Q+W$$
$$Q=ΔU+W’$$
の2種類が存在しており、気体がされた仕事の場合はW、気体がした仕事の場合はW’を使います。
気体がされた仕事Wと気体がした仕事W’には
$$W=-W’$$
という関係があります。
これを使うことで
$$ΔU=Q+W\\
ΔU=Q-W’\\
Q=ΔU+W’$$
と式変形をすることができます。
問題集や参考書によっては、2つの式を使い分けるという説明もあるのですが、覚える公式は
$$ΔU=Q+W$$
の1つだけで良いです!
「気体が仕事をした」場合は、「気体がされた仕事」の符号を逆転させましょう。
例題
例題1
気体に50Jの熱を加え、さらに外部から20Jの仕事をした。気体の内部エネルギーは何J増加するか。
例題2
気体に3.0×105 Jの熱を与えたところ、気体の内部エネルギーが1.0×105 J増加した。この間に気体が外部にした仕事は何Jか。
まとめ
内部エネルギーとは物体の分子の持つ運動エネルギー+位置エネルギーのことなのですが、位置エネルギーは無視するので運動エネルギーしか考えません。
熱力学第一法則は
$$ΔU=Q+W$$
の方の公式を使います。
Wは「気体がされた仕事」なので、「気体が仕事をしている」場合を聞かれたときは、気体がされた仕事Wの符号を変えましょう。












