今回は、等温変化と断熱変化についてわかりやすく簡単に解説していきます。よろしくお願いいたします。
等温変化とは
等温変化
気体の温度を一定にしたまま圧力や体積を変化させること
$$ΔU=0$$
等温変化とは、気体の温度を一定にしたまま圧力や体積を変化させることです。
温度が一定ということは\(ΔT=0\)であるため、単原子分子理想気体のとき
$$\begin{eqnarray}ΔU&=&\frac{3}{2}nRΔT\\
&=&\frac{3}{2}nR×0\\
&=&0\end{eqnarray}$$
となります。温度が変化しないため内部エネルギーも変化しないのです。
単原子分子理想気体ではなく二原子分子理想気体のときは\(ΔU=\frac{5}{2}nRΔT\)であり、多原子分子の場合も\(ΔU\)は\(ΔT\)に比例することが分かっています。
つまり、等温変化のとき\(ΔU=0\)になるのです。

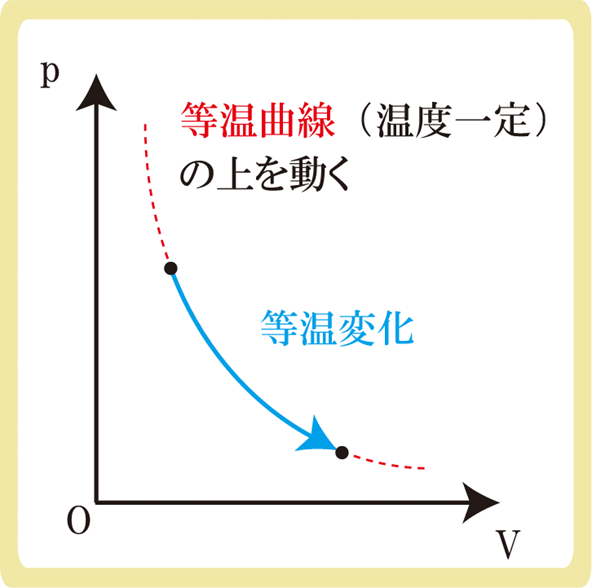
p-Vグラフにおいて、等温変化では圧力と体積の両方が変化するため、グラフは斜めに変化します。等温変化では等温曲線と呼ばれる曲線上を変化し、温度は変わりません
一見グラフ上の変化が等温変化なのかどうか分からないため、p-Vグラフの問題では等温変化かどうかよく問題に書いてあります。
なお、ボイルの法則より、等温変化では\(pV=一定\)です。
断熱変化とは
断熱変化
外部と熱のやり取りをしない変化のこと
$$Q=0$$
断熱変化とは、外部と熱のやり取りをしない変化のことで、\(Q=0\)です。
断熱変化では圧力p、体積V、温度Tの全てが変化します。
よくある勘違いなのですが、熱を貰わなくても温度は上がりますし、逆に、熱を放出しなくても温度が下がることもあります。
「断熱変化か、熱を貰わないから温度が変わらないな」と勘違いしないでください。断熱変化はあくまでも熱のやり取りがない、\(Q=0\)の変化です。

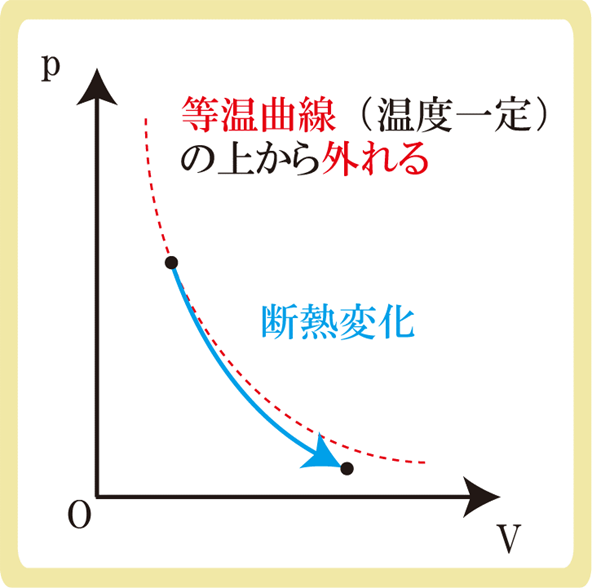
p-Vグラフにおいて、断熱変化でも圧力pと体積Vの両方が変化するため、グラフ上を斜めに移動します。さらに、断熱変化では温度Tも必ず変化するので、グラフは等温曲線から外れます。
断熱変化では、膨張するときは必ず温度が下がり(断熱膨張)、圧縮されるときは必ず温度が上がる(断熱膨張)ので、上図のように、等温曲線から外れている場合は断熱変化だと判断すればいいでしょう。
例題
例題1
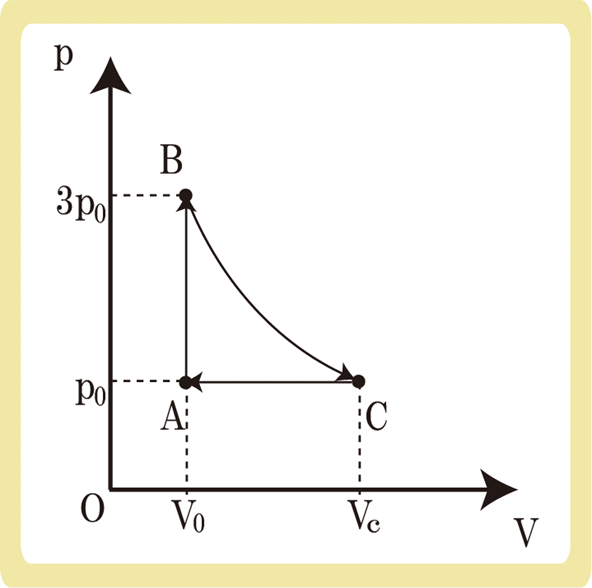
下図のように、物質量が一定の理想気体をA→B→C→Aの順に変化させた。Aのときの絶対温度をT0とするとき、以下の各問に答えなさい。ただし、状態B→Cの変化では温度が一定であるとする。
(1)Bの絶対温度を、T0を用いて表しなさい。
(2)Cにおける体積VCを、V0を用いて表しなさい。
(3) B→Cの変化でQの熱量を与えたとき、気体のした仕事を求めなさい。

解答
まず単原子分子理想気体かどうかの確認をします。今回はただの理想気体なので、\(ΔU=\frac{3}{2}nRΔT\)は使いません。
後は、(1)(2)(3)において、何変化であるのかを考えましょう。
(1) A→Bの定積変化を考えます。
前回解説しましたが、物質量が一定のとき、定積変化では圧力が3倍になると絶対温度も3倍になります。
∴3T0
(2) B→Cの等温変化を考えます。
等温変化では温度が一定であるため、Cでの温度はBと同じ3T0です。
等温変化では、物質量が一定のとき\(pV=一定\)であるため(ボイルの法則)、BとCのpVを比べると
$$3p_0×V_0=p_0×V_C\\
$$V_C=3V_0$$
∴3V0
(3) B→Cの等温変化を考えます。
等温変化では、気体がされた仕事Wを求める公式はありません。従って、熱力学第一法則\(ΔU=Q+W\)を用いて仕事を求めます。
今回は、問題文より熱量がQであると分かっていることと、等温変化では\(ΔU=0\)であるため、
$$ΔU=Q+W\\
0=Q+W\\
W=-Q$$
となります。
気体のされた仕事が-Qということは、気体のした仕事W’は\(W’=Q\)と分かります。
∴Q
例題2
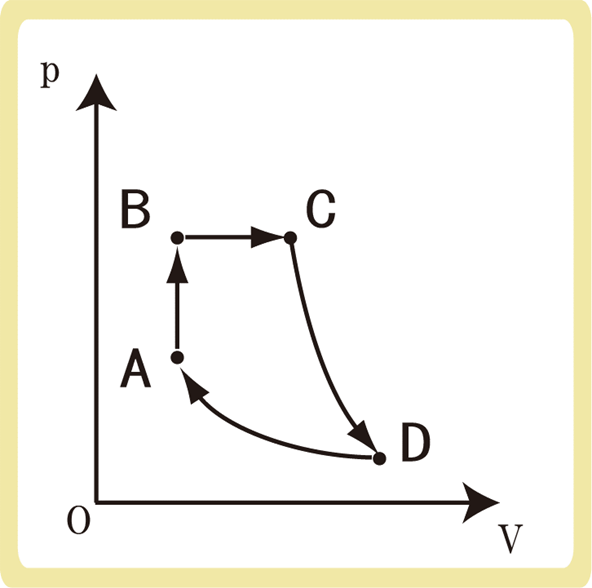
下図のように、物質量が一定の理想気体をA→B→C→D→Aと状態変化させた。このとき、各変化における内部エネルギーの変化ΔU、気体が吸収した熱量Q、気体がされた仕事Wについて、+、-、0のいずれかを下の表に書きなさい。ただし、C→Dは断熱変化、D→Aは等温変化であるとする。

解答
とりあえず、単原子分子理想気体ではないので\(ΔU=\frac{3}{2}nRΔT\)は使いません。
そもそも、この問題は+、-、0のどれかを答える問題であるため、0以外の具体的な数値は出てきません。
ΔU、Q、Wの3つのうち2つ分かれば、残りは\(ΔU=Q+W\)で求めることができるため、なんとかしてΔU、Q、Wのうち2つを求めましょう。
基本的な考え方は、
・p-Vグラフでは右上に向かうほど温度が大きくなるため、上か右に移動しているときはΔTが+であり、ΔUも+となる
・気体が圧縮されていたら「された仕事W」はプラス、気体が膨張していたら「された仕事W」はマイナス
です。
(i)A→Bについて
A→Bは定積変化であるため、\(W=0\)です。
また、p-Vグラフでは右上に向かうほど温度が大きくなるため、A→Bでは温度が上昇していると分かります。つまり、ΔTは+です。
\(ΔU\)は\(ΔT\)に比例しているため、ΔTが+ならばΔUも+になります。
最後に、\(ΔU=Q+W\)より、ΔUが+で、Wが0ならば、Qも+であることが分かります。
(ii)B→Cについて
B→Cは定圧変化なので、Wは0ではありません。気体の体積が増えている(膨張している)ため、気体がされた仕事は-になります。
また、B→Cではグラフが右に移動しているため、ΔTが+になり、ΔUも+になります。
最後に、\(ΔU=Q+W\)より、ΔUが+で、Wが-ならば、Qは+であることが分かりますね。
(iii)C→Dについて
C→Dは断熱変化であるため、Q=0です。
また、B→C同様、気体の体積が増えている(膨張している)ため、気体がされた仕事は-になります。
最後に、\(ΔU=Q+W\)より、Qが0で、Wが-ならば、ΔUも-であることが分かります。
断熱膨張なので、温度は必ず下がると覚えても良いでしょう。
(iiii)D→Aについて
D→Aは等温変化であるため、ΔU=0です。
また、気体の体積が減っている(圧縮している)ため、気体がされた仕事は+になります。
最後に、\(ΔU=Q+W\)より、ΔUが0で、Wが+ならば、Qは-であることが分かります。
まとめると、
|
ΔU |
Q |
W |
| A→B |
+ |
+ |
0 |
| B→C |
+ |
+ |
– |
| C→D |
+ |
0 |
– |
| D→A |
0 |
– |
+ |
となります。
まとめ
等温変化は、温度が一定の変化であり、ΔU=0
断熱変化は、外部と熱のやり取りをしない変化であり、Q=0
「断熱変化は熱を貰っていないし温度が変化しない!」と、よく勘違いされますが、断熱変化は必ず温度が変化します。
次の内容はこちら
一覧に戻る