・理想気体とは
・理想気体と実在気体の違い
・理想気体の状態方程式とは
理想気体の状態方程式とは、ボイル・シャルルの法則をさらに発展させたものです。
実存気体の状態方程式等、「理想気体の状態方程式」以外にも状態方程式が存在するため、教科書や参考書ではしっかり「理想気体の状態方程式」と書かれていることが多いのですが、高校生は「状態方程式」と略してしまうことが多い印象です。
今回は、理想気体の状態方程式とは何か、わかりやすく簡単に解説していきます。
理想気体とは
分子の大きさがなく、分子間力がはたらかない気体
ボイル・シャルルの法則や理想気体の状態方程式が成立する気体
理想気体とは、分子の大きさがなく、分子間力がはたらかない気体のことです。
理想気体と実在気体の違い
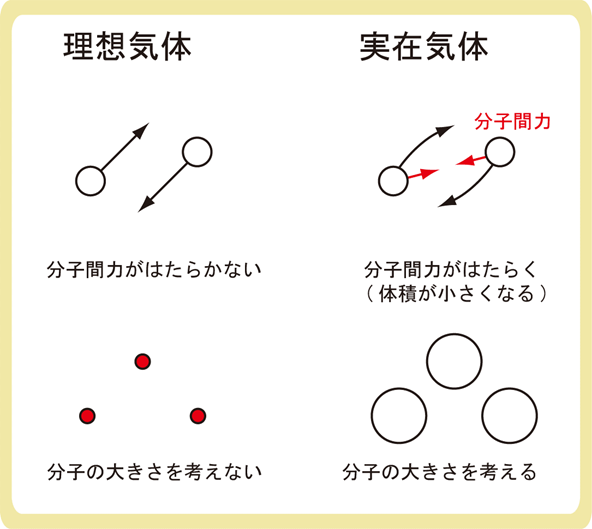
O2やN2のように、実際にある気体のことを実在気体といいます。
実在気体では、分子間力がはたらき、分子の大きさを考えます。
分子間力とは何か、実在気体と理想気体の違いの詳細については、物理ではなく化学の範囲であるため、詳しくは化学の方で勉強しましょう。
理想気体とは
理想気体とは、分子の大きさがなく、分子間力がはたらかない気体のことですが、ボイル・シャルルの法則や理想気体の状態方程式が成立する気体が理想気体であると表現することもできます。
高校物理では実在気体を考えることはまずないため、扱う気体は全て理想気体であると思ってください。
理想気体の状態方程式とは
理想気体における圧力、体積、物質量、絶対温度の関係式のこと
$$pV=nRT$$
(p:圧力[Pa]、V:体積[m3]、n:物質量[mol]、R:気体定数[J/(kg・K)]、T:絶対温度[K])
理想気体の状態方程式とは、理想気体における圧力、体積、物質量、絶対温度の関係式のことであり、\(pV=nRT\)のことです。
理想気体の状態方程式の導出
ボイル・シャルルの法則\(\frac{pV}{T}=一定\)に出てきた”一定”の値を求めるため、標準状態かつ気体の物質量が1molのときを考えます。
(標準状態とはT=273K(0℃)、p=1.013×105 Paのことです。)
1molは22.4Lであり、22.4×10-3 m3(1mL=1cm3)であるため、これらの値をボイル・シャルルの法則に代入すると、
$$\begin{eqnarray}\frac{pV}{T}&=&\frac{1.013×10^5×22.4×10^{-3}}{273}\\
\frac{pV}{T}&≒&8.31\end{eqnarray}$$
となり、この数値を気体定数R[J/(mol・K)]といいます。
この気体定数を使うと、1molのとき、
$$\frac{pV}{T}=R$$
となります。これは1molのときの話でしたが、物質量をn[mol]とすると、体積の値がn倍となるため、
$$\frac{pV}{T}=nR\\
pV=nRT$$
となります。
高校物理の熱力学分野の中でも、最も大事な式の1つであるため、絶対に覚えておきましょう。
例題
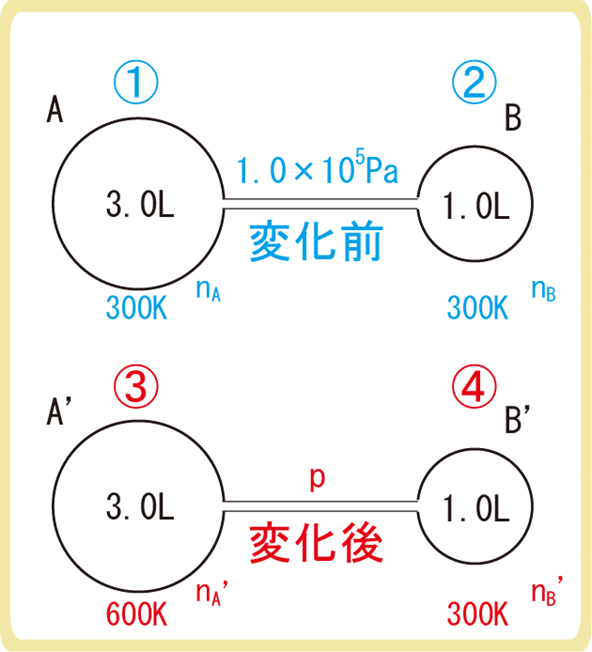
例題1
下図のように、大きさが3.0Lと1.0Lの2つの容器A,Bが細い管でつながれ、中に温度300K、圧力1.0×105Paの空気が密閉されている。容器Bを300Kに保ちながら容器Aの温度を600Kに上昇させると、容器内の圧力は何Paになるか。
まとめ
理想気体の状態方程式は、非常に大切な式です。
$$pV=nRT$$
を必ず覚えておきましょう。